裸鼹鼠(Heterocephalusglaber)是一种寿命极长的啮齿类动物,其寿命可达30-40年,是同体型啮齿动物(例如小鼠)寿命的10倍以上。
一直以来,裸鼹鼠因为其长寿和抵抗衰老相关疾病(包括癌症、心血管疾病、神经退行性疾病)的强大能力而备受科学界关注。尽管人们认为其超长寿命是由影响多种生物过程的多种适应性变化共同作用的结果,但保护裸鼹鼠免受基因组不稳定(衰老的主要标志)影响的分子机制,目前仍不清楚。
2025年10月9日,同济大学生命科学与技术学院/附属妇产科医院毛志勇教授、蒋颖副教授作为共同通讯作者(陈御、陈芷茜为共同第一作者),在国际顶尖学术期刊Science上发表题为:AcGAS-mediatedmechanisminnakedmole-ratspotentiatesDNArepairanddelaysaging的研究论文[1]。
该研究首次揭示了裸鼹鼠的cGAS蛋白上4个特定的氨基酸突变,导致cGAS这一人类细胞中的DNA修复抑制因子转化为修复增强因子,从而发挥增强DNA修复、对抗细胞和组织衰老、延长寿命和健康寿命的作用。
这项研究证实了调控cGAS可作为一种延长寿命的新策略,未来或可通过小分子药物或基因编辑等方式来模拟裸鼹鼠cGAS的特有突变,以帮助人类延缓衰老、延长健康寿命。

DNA修复是维持基因组稳定的关键机制。早在2018年,同济大学戈宝学、毛志勇合作团队在Nature期刊发表论文,发现在人类细胞中,DNA传感器cGAS通过抑制同源重组(HR)途径参与调控DNA双链断裂的修复,从而促进基因组不稳定。尽管DNA修复蛋白功能的增强有助于长寿的进化,但进化是否选择减弱诸如cGAS这样的负调控因子,仍不得而知。

在这项发表于Science期刊的最新研究中,研究团队发现,与人类及小鼠的cGAS相比,裸鼹鼠的cGAS增强了同源重组修复的效率。这种功能逆转是由cGAS蛋白C端结构域内的4个特定氨基酸残基的替换(S463、E511、Y527、T530)所介导的。突变裸鼹鼠cGAS的这4个位点,会导致其丧失促进修复的能力,而将这4个位点引入人类cGAS,可消除其对同样重组的抑制。
从机制上来说,cGAS上的这种氨基酸的改变,使裸鼹鼠的cGAS能够通过调控其泛素化状态,延长其在DNA损伤后的染色质上的保留时间,从而改变其与分离酶P97的相互作用。裸鼹鼠cGAS在染色质上的延长存在促进了经典同源重组因子RAD50与主要与范可尼贫血途径相关的FANCI之间的复合物形成。研究团队进一步证明,FANCI促进了RAD50在染色质上的募集,从而增强了同源重组修复。因此,裸鼹鼠的cGAS减轻了应激诱导的细胞衰老,缓解了器官退化,并延长了果蝇的寿命。关键的是,恢复这4个氨基酸改变则消除了这些保护作用。
此外,研究团队使用腺相关病毒(AAV)将裸鼹鼠cGAS递送至老年小鼠体内,可减轻其虚弱症状,减缓毛发变白,降低循环免疫球蛋白G(IgG)和白细胞介素-6(IL-6)的水平,并减少多个组织中的细胞衰老标志物,降低系统炎症,延长健康寿命。这些结果表明,裸鼹鼠的cGAS有助于缓解个体的衰老、延长健康寿命。
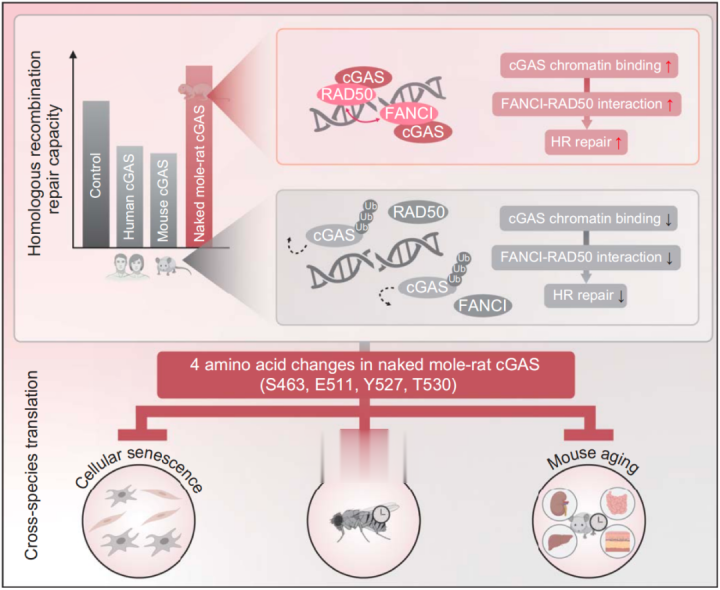
总的来说,该研究通过比较分子生物学分析,揭示了在最长寿的啮齿动物裸鼹鼠的体内,cGAS在同源重组修复中的负调控功能被逆转,这是由于cGAS蛋白上的4个特定氨基酸的突变,这种改变赋予了裸鼹鼠cGAS更强的稳定基因组的能力,能够对抗细胞衰老和器官老化,从而延长寿命和健康寿命。
相关阅读:
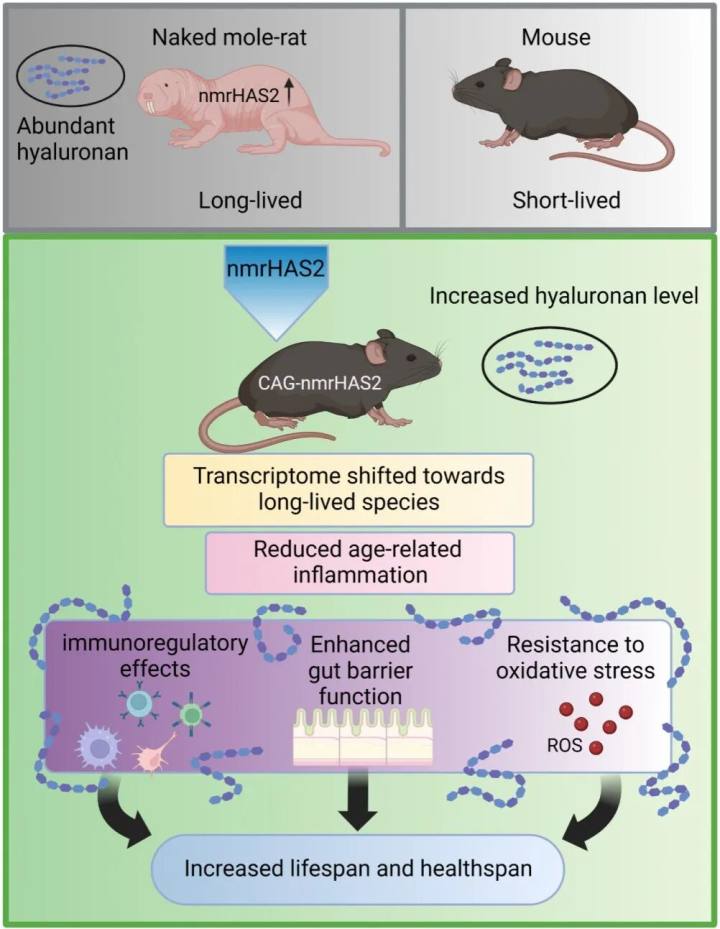
2023年8月23日,美国罗切斯特大学VeraGorbunova和AndreiSeluanov团队(张智辉为第一作者)在Nature期刊发表了题为:Increasedhyaluronanbynakedmole-ratHAS2improveshealthspaninmice的研究论文[2]。
该研究将裸鼹鼠透明质酸合成酶2基因(nmrHAS2)转基因到小鼠中,从而改善了小鼠的健康状况,并延长了其寿命和健康寿命。这项开创性工作首次证明了裸鼹鼠的长寿与抗癌机制可以被转化到其他短寿物种中。

论文链接:
https://www.science.org/doi/10.1126/science.adp5056
https://www.nature.com/articles/s41586-023-06463-0




