碳氧双键(以下将从原子结构参数、成键机制、热力学数据及实际化合物稳定性等角度展开详细分析,并结合资料中的具体图表进行深入阐释。
原子半径差异对成键强度的影响
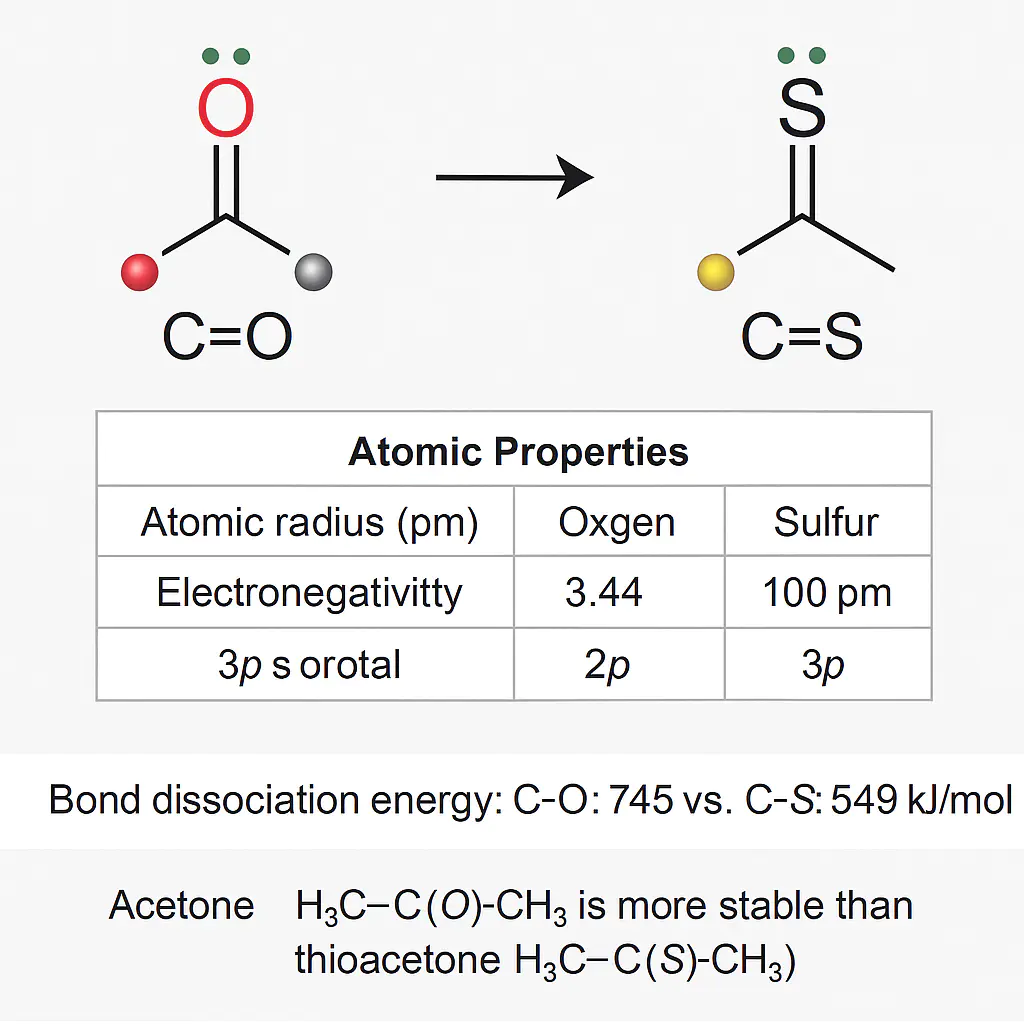
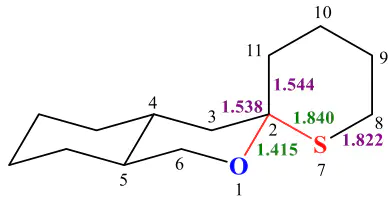
氧原子的共价半径(约1.02 Å),这一差异直接导致成键时轨道重叠效率的显著不同。“在C=S键中,硫原子较大的半径迫使碳原子与硫原子间距增大(典型C=S键长约,而键仅)。这种过长的键长直接削弱了原子轨道间的有效重叠,尤其影响π键的形成。资料中的分子结构图清晰展示:硫原子与相邻碳原子的键长达(远高于键的1.4 Å级),且环结构中多个C-S键长均稳定在1.83–1.84 Å范围,直观体现了硫原子因半径过大导致的成键松散性。
6
电负性差异
氧的电负性(3.44)显著高于硫(2.58),导致C=O键具有强极性(电负性差≈0.94),而C=S键极性较弱(电负性差≈0.06)。电负性差>0.4即形成极性共价键,而C=S键的电负性差接近非极性键范畴。
强极性使C=O键的电子云高度偏向氧原子,碳原子带明显正电(δ+),这种电荷分离增强了静电吸引作用,大幅提升键能(C=O键能约799 kJ/mol,C=S仅540 kJ/mol)。
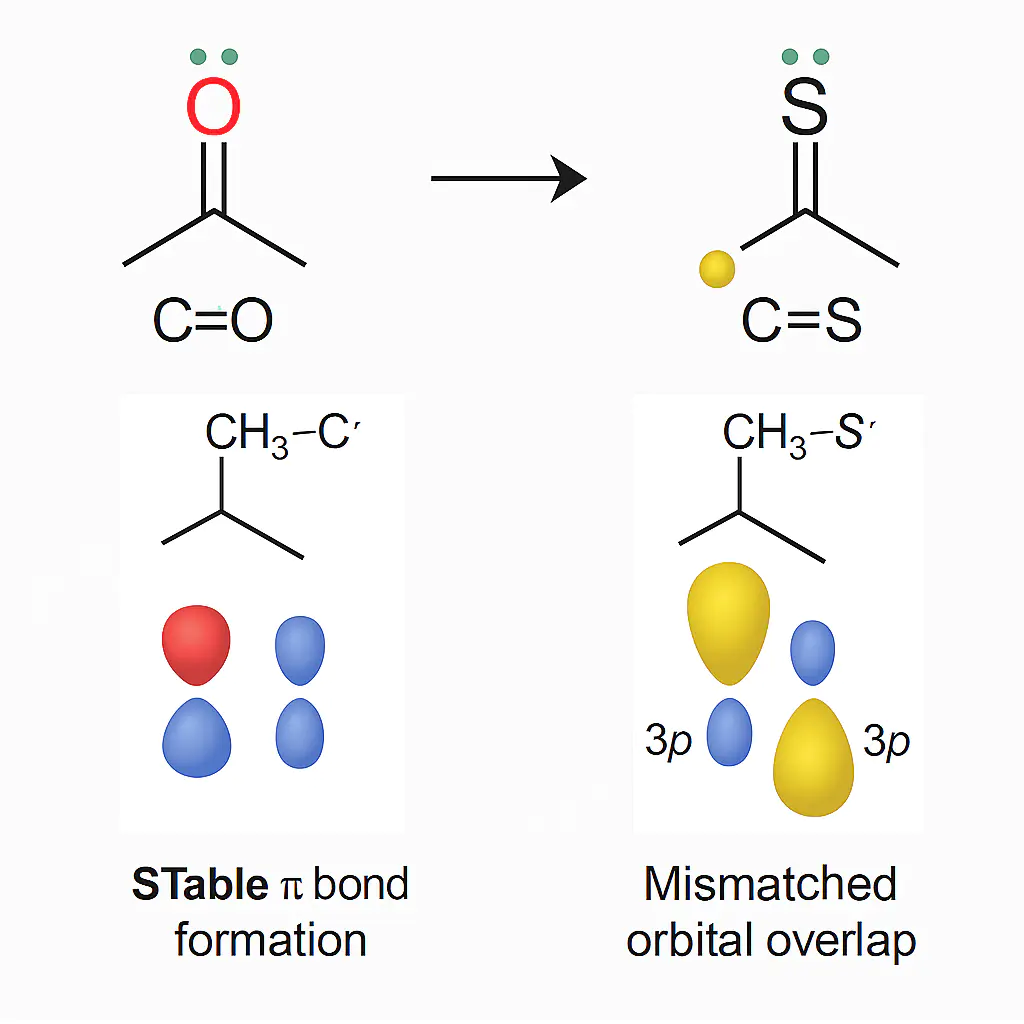
3p-10.0 eV2p-8.7 eV1.3 eV2p4.9 eV碳原子(价层轨道)与硫原子(3p轨道)的主量子数差异(n=2 vs n=3)引发关键轨道对称性问题:
氧的轨道与碳2p轨道尺寸匹配(半径比≈1:1.4),实现高效“肩并肩“重叠,形成强π键(键级≈2)。
硫的轨道比碳2p轨道大40%以上,导致“大轨道–小轨道“的失配重叠。硫原子体积大、电负性小,其3p轨道径向分布更分散,与碳2p轨道的侧向重叠面积显著缩减,π键电子云密度降低约50%。
这种失配使而氧无可用d轨道,C=O的π键保持高定域性,稳定性不受干扰。
热分解行为的证据对比
C=O羧基()需400°C以上分解,羰基(C=O)在1200°C仍存在,醚键(C-O)甚至需1730°C才能完全断裂。
含硫化合物:及的表格数据表明:硫醇(C-SH)在即分解(如正丁基硫醇分解);硫醚(C-S-C)在分解(二乙基硫醚);噻吩(含C=S环)虽需**>800°C**,在CO₂气氛中分解温度可降至600°C以下,显示内在不稳定性。
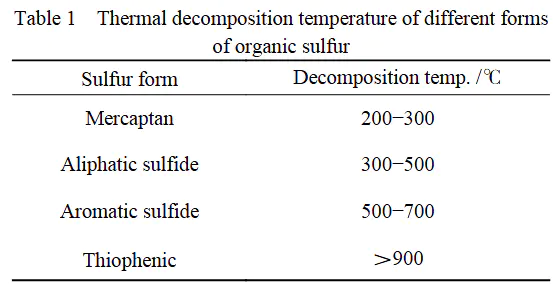
对比可见,最不稳定的含氧基团(羧基)分解温度仍高于最稳定的硫醚(噻吩除外),而典型键化合物(如硫酮)在室温下即易发生二聚或水解,实验室需低温保存。
生物与地质化学的稳定性选择
生命体几乎全部选择而非C=S(如蛋白质主链为酰胺键而非硫代酰胺),因C=O键能提供稳定氢键受体(氧原子高电负性),维持酶活性中心精确构象(水分子键角105° vs 硫化氢92°)
矿物形成:Ca²⁺碳氧双键的卓越稳定性源于氧原子的小半径(强化轨道重叠)、高电负性(增强静电吸引)及轨道的完美匹配(形成强定域π键);反观碳硫双键,硫的大半径(导致键长过长)、低电负性(弱化极性)及3p-2p轨道失配(π键脆弱)使其成为有机化学中最不稳定的重键之一。这一差异在热分解温度、化合物反应性及自然界的化学选择中均得到充分印证。