
Chronic Diseases and Translational Medicine 2025年3期发表了来自美国St. John's University的Letao Bo等作者的文章,题目为“Tislelizumab: Structural Innovations and Expanding Clinical Horizons in Next-Generation PD-1 Immunotherapy”(Tislelizumab:新一代PD-1免疫疗法的结构创新与临床前景拓展)。该综述系统探讨了Tislelizumab作为新一代PD-1单克隆抗体的结构优势、临床疗效及未来发展前景,为肿瘤免疫治疗提供了重要理论依据和实践指导。

Tislelizumab是一种经过工程化改造的新一代PD-1抑制剂,其独特之处在于通过Fc区域的三重突变设计,最大限度地减少与Fcγ受体的结合,从而避免巨噬细胞介导的T细胞清除现象。与传统PD-1抑制剂(如nivolumab和pembrolizumab)相比,Tislelizumab能够更精确地模拟天然PD-1/PD-L1相互作用方式,与PD-1结合时显示出更高的亲和力(Kd值为130 pM),且结合位点与PD-L1结合位点重叠度达到约80%,这一特性使其在阻断免疫检查点信号传导时具有显著优势。
在临床进展方面,Tislelizumab自2019年12月首次在中国获批用于经典霍奇金淋巴瘤以来,已陆续获得包括美国FDA和欧洲委员会在内的多个监管机构批准,适应症扩展至非小细胞肺癌、食管鳞状细胞癌、胃食管结合部腺癌等多个癌种。最新临床数据显示,该药物在晚期实体瘤患者中表现出持久的抗肿瘤活性,中位无进展生存期和总生存期均较传统化疗有显著改善。
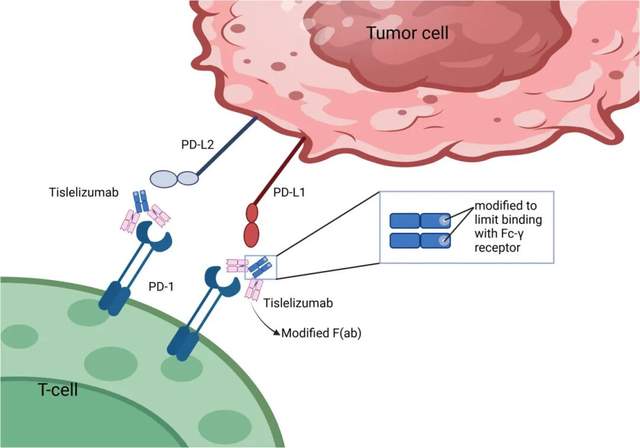
The interaction of tislelizumab with PD-1/PD-L1 in the tumor microenvironment. Tislelizumab targets PD-1 on T-cells, blocking its interaction with PD-L1 on tumor cells. This action is facilitated by a modified F(ab) region to limit Fc-γ receptor binding, enhancing the antitumor immune response. PD-1, programmed cell death protein 1; PD-L1, programmed cell death 1 ligand 1; PD-L2, programmed cell death 1 ligand 2.
安全性分析表明,Tislelizumab的免疫相关不良事件(irAEs)发生率相对较低。FDA不良事件报告系统的数据显示,其irAEs的报告比值比(ROR=1.69)显著低于nivolumab(ROR=2.21)和pembrolizumab(ROR=2.35),这一优势可能归因于其Fc区域的特异性改造,减少了非靶向免疫激活带来的副作用。
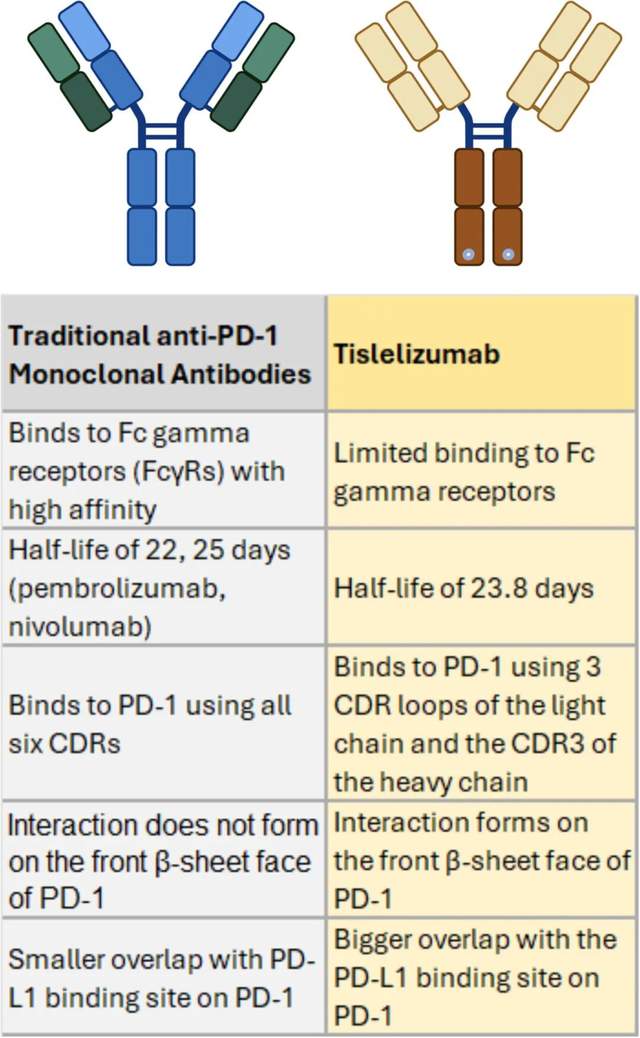
Comparative analysis of traditional anti-PD-1 monoclonal antibodies and tislelizumab. Traditional antibodies bind to Fc gamma receptors (FcγRs) with high affinity and use all six CDRs to bind PD-1, whereas tislelizumab has limited FcγR binding and uses specific CDR loops for PD-1 binding. Tislelizumab also forms interactions on the front β-sheet face of PD-1, with a greater overlap at the PD-L1 binding site, enhancing its therapeutic efficacy. PD-1, programmed cell death protein 1; CDR, complementarity-determining region.
在联合治疗策略方面,研究团队系统梳理了Tislelizumab与化疗、放疗及其他免疫调节剂的协同作用。例如,与吉西他滨+顺铂联合治疗局部晚期或转移性膀胱癌时,联合疗法相比单纯化疗显著延长了无进展生存期和总生存期;与立体定向放疗联合用于可切除非小细胞肺癌的新辅助治疗时,主要病理缓解率达到76%。这些数据为个体化治疗方案的制定提供了重要参考。
未来发展方向包括生物标志物的精准识别、联合治疗策略的优化以及安全性管理体系的完善。研究表明,微卫星不稳定性高、肿瘤突变负荷高以及干扰素-γ相关基因特征可能成为预测Tislelizumab治疗反应的潜在生物标志物。此外,该药物在慢性病毒感染治疗领域的拓展应用也显示出潜在价值,为免疫调节治疗的跨疾病应用提供了新思路。
Tislelizumab通过结构创新实现了疗效与安全性的平衡,其全球获批和临床实践为肿瘤患者提供了新的治疗选择。随着生物标志物研究和联合治疗方案的深入推进,这一新一代PD-1抑制剂有望在精准免疫治疗领域发挥更大价值。