药物临床试验登记与信息公示平台数据显示,湖南普道医药技术有限公司的磷酸奥司他韦颗粒(0.9g(按C₁₆H₂₈N₂O₄计))与中外製薬株式会社持证的磷酸奥司他韦干糖浆(规格:3%(30g),商品名:Tamiflu®)在中国健康受试者中进行的随机、开放、单剂量、两序列、两周期、空腹和餐后状态下的生物等效性研究已启动。临床试验登记号为CTR20254428,首次公示信息日期为2025年11月20日。
该药物剂型为颗粒剂,用法为口服,空腹试验在空腹条件下进行,餐后试验在高脂高热餐后进行,均为单次给药,一次2.5g(以奥司他韦计75mg)。本次试验目的是考察两制剂在空腹和餐后状态下单次给药的药代动力学参数及相对生物利用度,评价两制剂是否具有生物等效性,同时评价两种制剂在健康人体中的安全性。
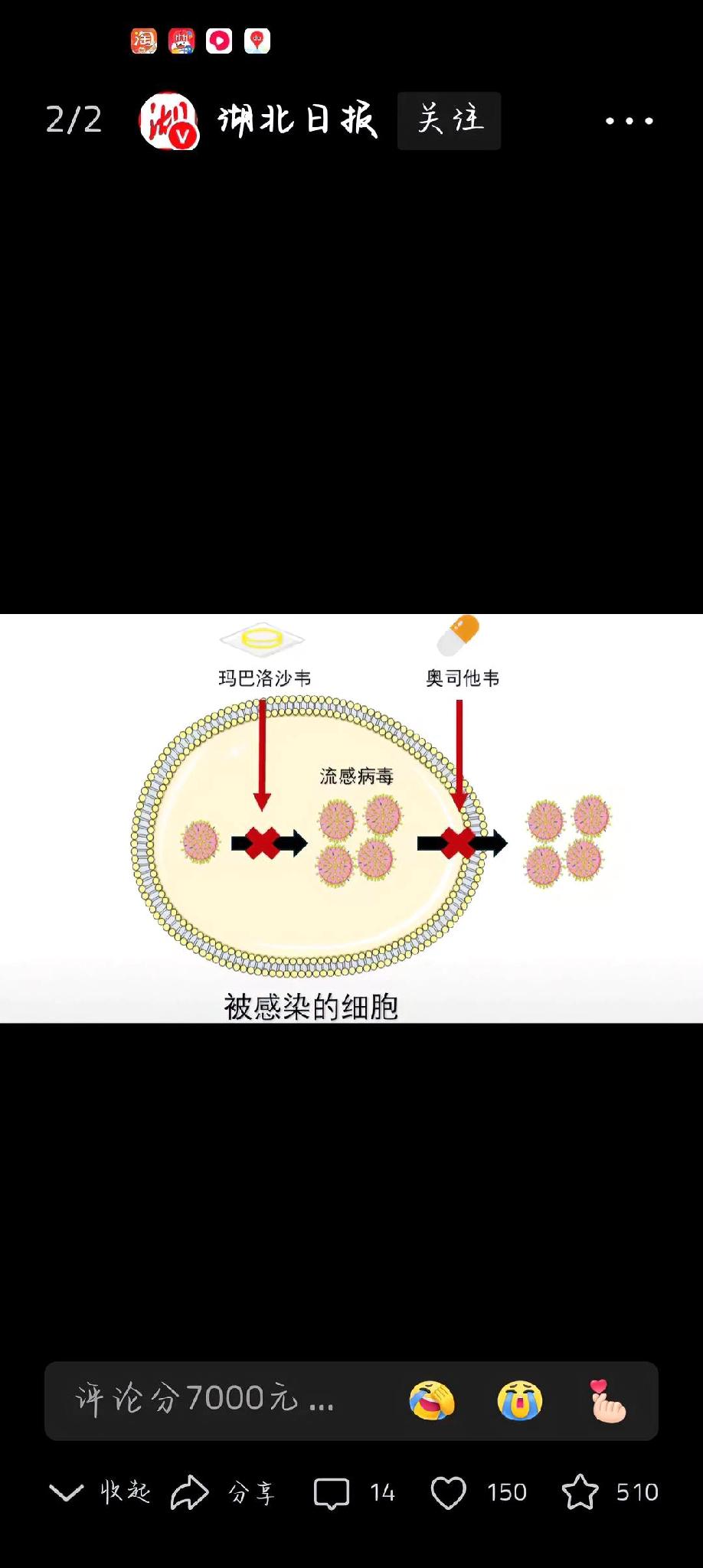
磷酸奥司他韦颗粒为化学药物,适应症为A型或B型流感的治疗和预防。流感是由流感病毒引起的急性呼吸道传染病,症状包括高热、乏力、头痛、咳嗽等。通过病毒核酸检测等可诊断,治疗以抗病毒药物为主。
本次试验主要终点指标包括Cmax、AUC₀₋ₜ、AUC₀₋∞;次要终点指标包括Tmax、T₁/₂z、λz等药动学参数;生命体征检查、体格检查、实验室检查、心电图检查、不良事件(AEs)/严重不良事件(SAEs)。
目前,该实验状态为进行中(尚未招募),目标入组人数64人。
风险提示:市场有风险,投资需谨慎。本文为AI大模型基于第三方数据库自动发布,任何在本文出现的信息(包括但不限于个股、评论、预测、图表、指标、理论、任何形式的表述等)均只作为参考,不构成个人投资建议。受限于第三方数据库质量等问题,我们无法对数据的真实性及完整性进行分辨或核验,因此本文内容可能出现不准确、不完整、误导性的内容或信息,具体以公司公告为准。如有疑问,请联系biz@staff.sina.com.cn。