ESMO 2025靶点全景图:谁能成为下一个千亿分子?
欧美颇具差异化优势和热度的CNS创新药寻找中国合作伙伴
欢
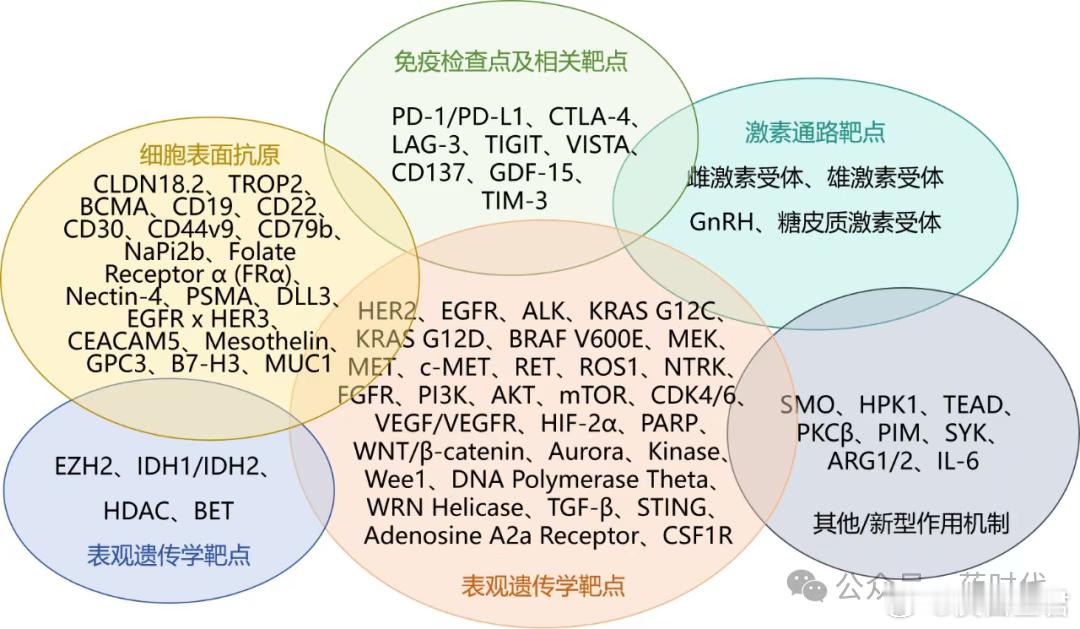
在ESMO2025官方议程&摘要里,共出现超50个靶点,涵盖IO、ADC、双抗、放射-配体、细胞疗法5大开发路径。
其中“ADC + IO”与“双抗/多抗”是2025年最显眼的联合主线,且每个靶点至少对应1种组合策略——单药获批只是起点,联合才是终局。
图1 ESMO2025靶点全景
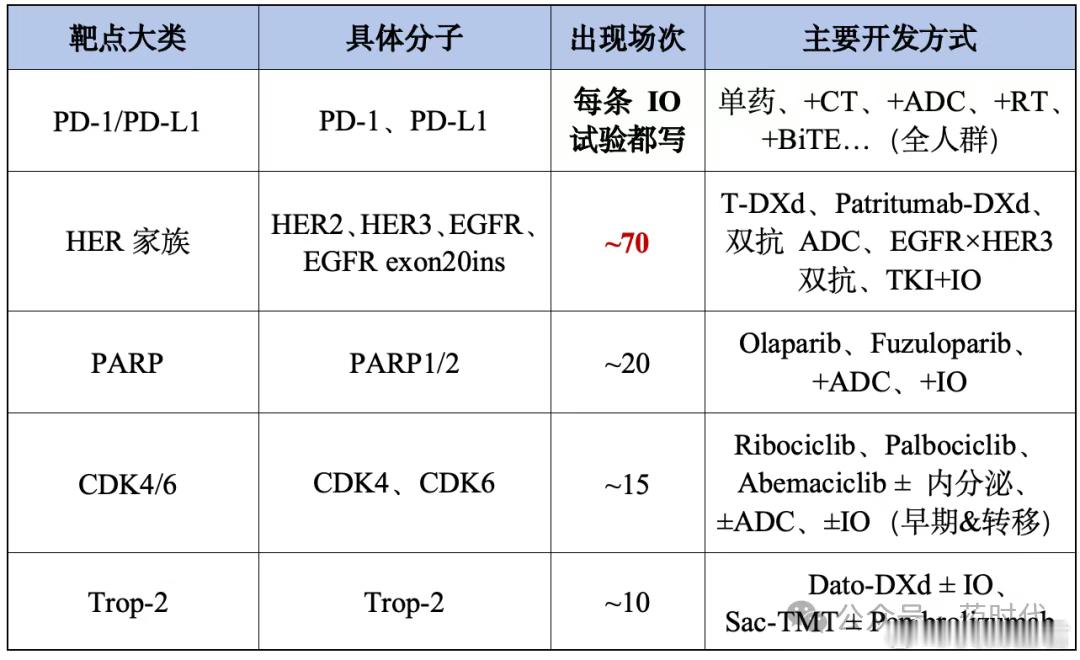
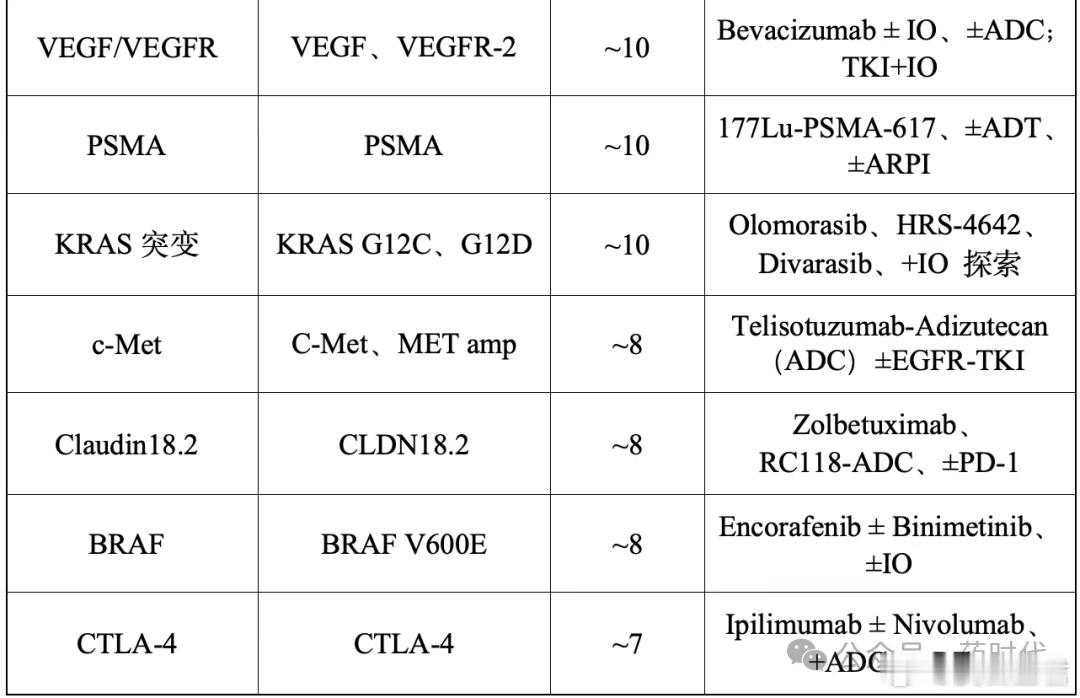
表1 ESMO讨论频次较高的12类靶点及主要开发方式趋势速览:
IO进入双抗+ADC复合时代:PD-1单药红利结束,IO平台型公司必须储备ADC或双抗管线,否则2027年后无故事可讲。
靶点下沉比新靶点更赚钱:HER2-low、HER3-low、Trop-2-low凭借ADC技术把原本“不可成药”的低表达变成30亿美元市场,平台价值>靶点本身。
核药与ADC抢同一批靶点:PSMA、SSTR2、FAP、GRPR已出现“ADC vs RLT”双线作战,诊断-治疗一体化(Theranostics)将成为MNC下一个百亿并购风口。
国产ADC迎来数据兑现季:科伦博泰、百利天恒、迈威生物等在ESMO首发人体数据,第一梯队2026年将集中报产,CDMO与linker-payload供应链最先受益。
01
IO与新型模式的复合
PD-1/L1单药疗法在多数癌种中遭遇瓶颈已是不争的事实。ESMO 2025的议程清晰地表明,未来的突破依赖于 “免疫检查点抑制剂+X”的复合疗法,其中X主要是抗体偶联药物(ADC)和双特异性抗体(BsAb)。
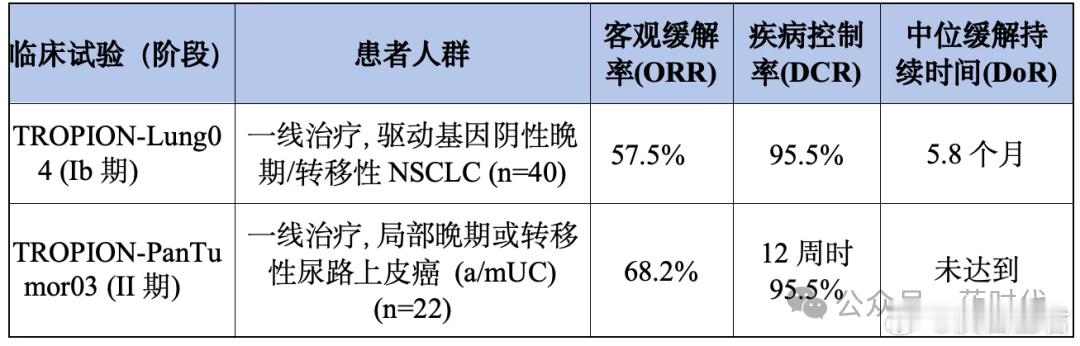
1.1 “双抗+ADC”成为核心组合①ADC+IO:多个专场探讨ADC与免疫 checkpoint 抑制剂的协同作用。例如,在肺癌、胃癌、尿路上皮癌的报告中,Datopotamab deruxtecan (Dato-DXd) + rilvegostomig (PD-1/TIGIT双抗)、Enfortumab Vedotin + Pembrolizumab等组合是绝对焦点。ADC通过杀伤肿瘤细胞,改变肿瘤微环境,从而增强IO疗效。
表2 Dato-DXd与rilvegostomig联合治疗的关键早期临床核心数据②双抗+IO:针对DLL3/CD3的BiTE药物Tarlatamab、针对CD3/CD20的双抗等,本身就在重塑小细胞肺癌、淋巴瘤的治疗格局,它们与PD-1/L1的联用也是研究热点。
1.2平台型公司的战略需求像BMS、罗氏、阿斯利康、默克等MNC,其卫星会和专题研讨会无一不在展示其“IO + ADC +双抗”的庞大产品矩阵。一个只有PD-1的公司,在议程中几乎“失声”。
02
ADC平台如何重新定义“可成药性”
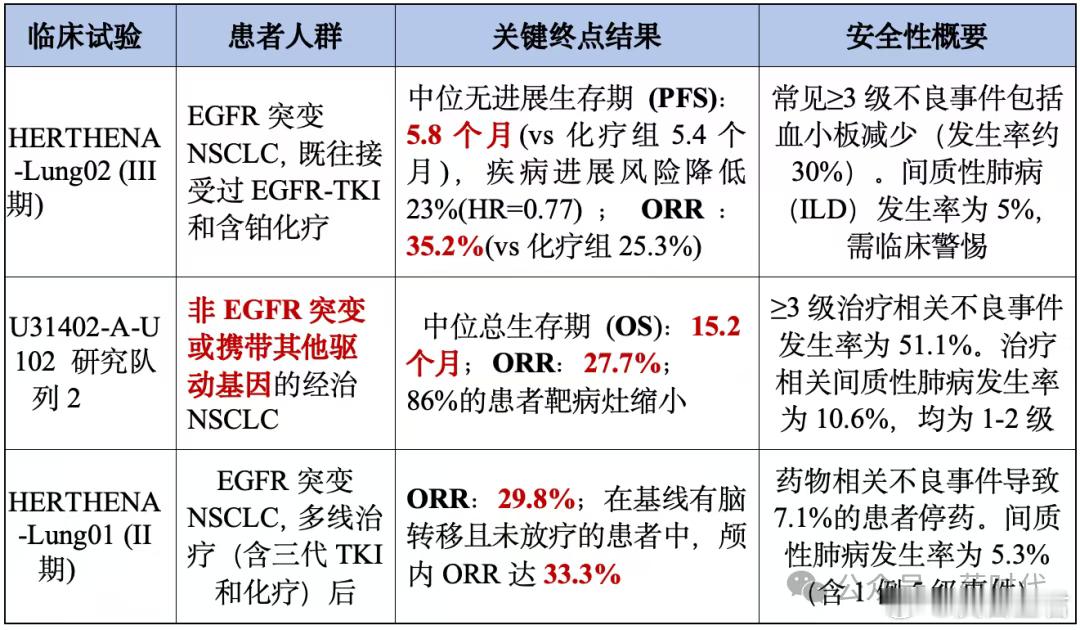
2.1“-low”概念的临床验证ESMO 2025议程中,TROPION-Breast02(Dato-DXd in TNBC)、TROPION-Lung05 (Dato-DXd in NSCLC) 等研究,本质上都是在治疗TROP-2-low人群。HER2-low已成为乳腺癌的标准分型,而针对HER3-low的ADC药物(如Patritumab deruxtecan在NSCLC中的数据)也在多个专场发布,证明了其在低表达肿瘤中的显著疗效。
表3 Patritumab deruxtecan临床核心数据
2.2“不可成药”变为“可成药”传统TKI或单抗对低表达靶点无效。ADC通过其“高效载药”的机制,只要肿瘤细胞有微量抗原表达,就能被精准投递的细胞毒素杀死。这将巨大的、原本无药可用的患者群体转化为了市场。
2.3平台价值>靶点本身德曲妥珠单抗的成功,关键不在于发现了HER2这个新靶点,而在于第一三共的DXd ADC技术平台。这个平台可以像“乐高”一样,更换不同的抗体去靶
向HER2、TROP2、B7-H3、CDH6等,实现“一个平台,多个爆款”。议程中多家公司的报告都体现了这种平台化战略。
03
核药与ADC在靶点上的交汇
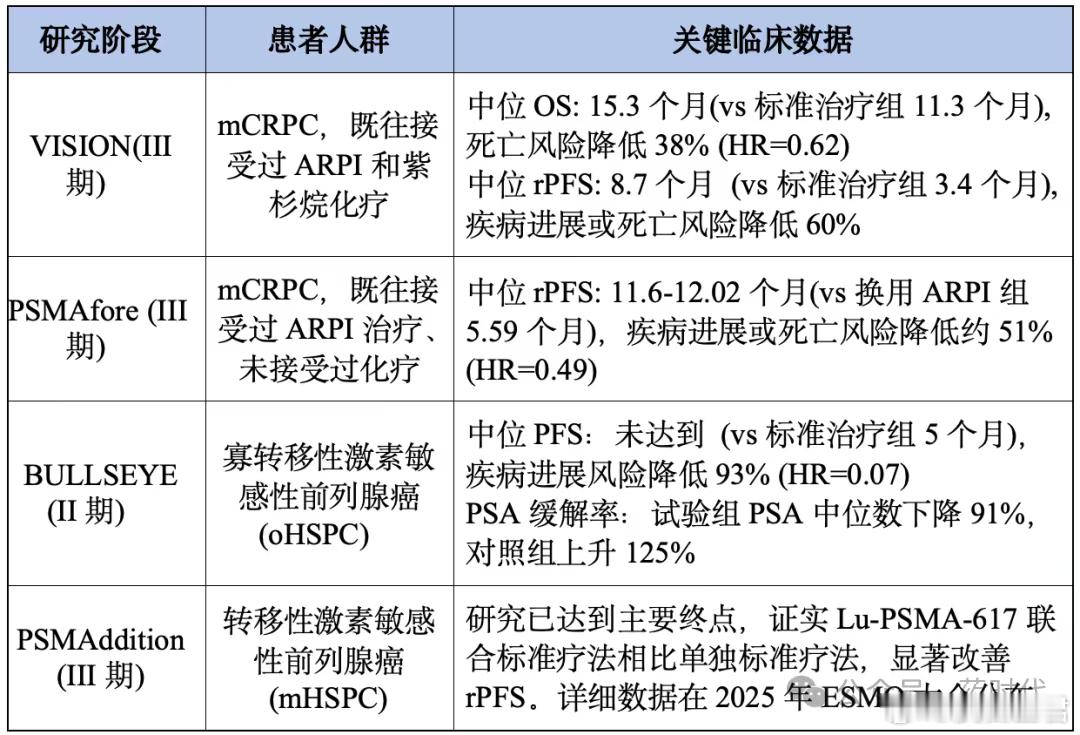
3.1 ADC vs RLT双线作战①PSMA:前列腺癌领域,Lu-PSMA-617 (核药) 与PSMA-targeted ADC的开发齐头并进。
表4 Lu-PSMA-617研究进展和临床数据表5 PSMA ADC药物临床研究数据
②SSTR2:神经内分泌瘤领域,Lu-DOTATATE是标准核药,而针对SSTR2的ADC也正在开发中。
③FAP:在多个实体瘤中,成纤维细胞激活蛋白是一个极具潜力的靶点,议程中同时出现了FAP-targeted RLT和FAP-targeted ADC的研究报告。
3.2诊断-治疗一体化成为风口核药天然具备看得到就能打到的优势(如用Ga-68 PSMA PET/CT诊断筛选患者,再用Lu-177 PSMA治疗)。议程中设有“Radioligand Therapeutics”专题会,讨论了如何扩大这一模式。
诺华通过收购AAA和Endocyte在该领域占据领先,但其他MNC(如拜耳、BMS)正在急起直追。下一个百亿级并购,极有可能发生在这个能实现精准患者分层和治疗的领域。
04
ESMO 2025是中国ADC力量的一次集中亮相
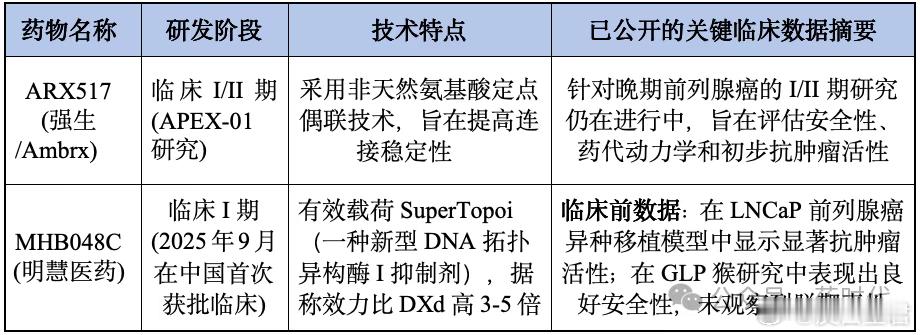
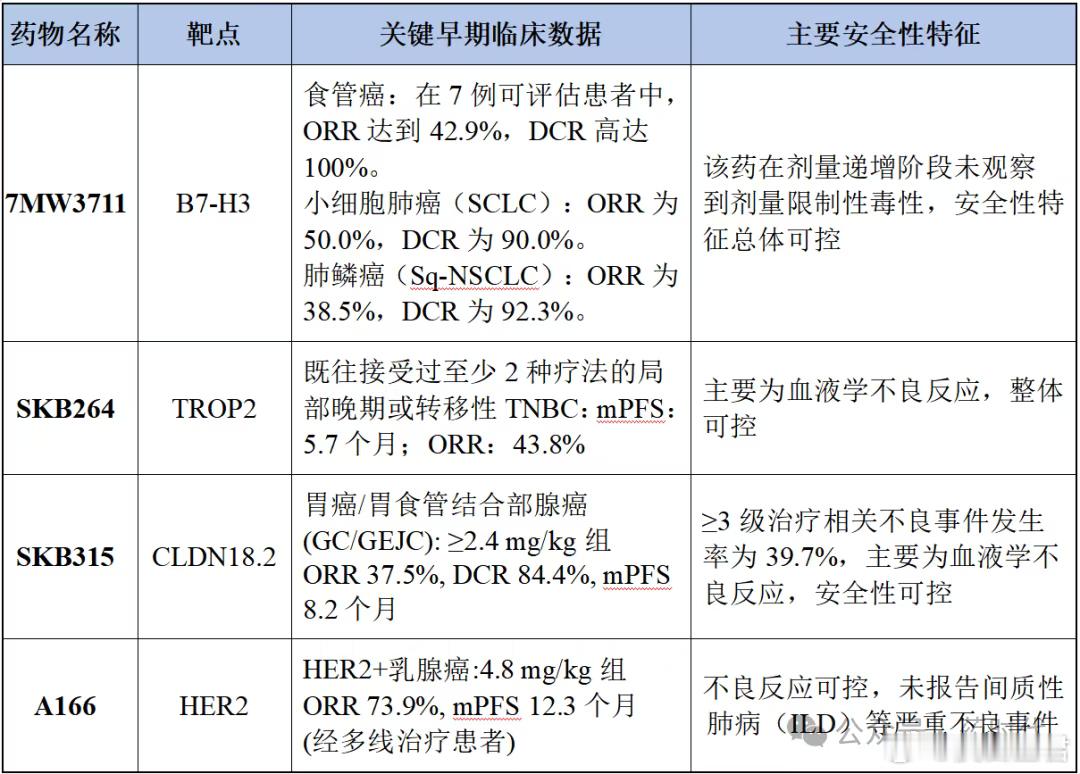
4.1临床数据大爆发7MW3711 (迈威生物,靶向B7-H3的ADC)、TQB2102(中国生物制药,靶向HER2的ADC)、SKB315 (科伦博泰,靶向CLDN18.2的ADC)、SKB264(科伦博泰,靶向TROP-2的ADC)、A166(科伦博泰,靶向HER2的ADC)、BL-B01D1(百利天恒,EGFRxHER3双抗ADC)等,在Mini Oral或Proffered Paper环节公布临床试验数据,展示了良好的疗效和安全性。
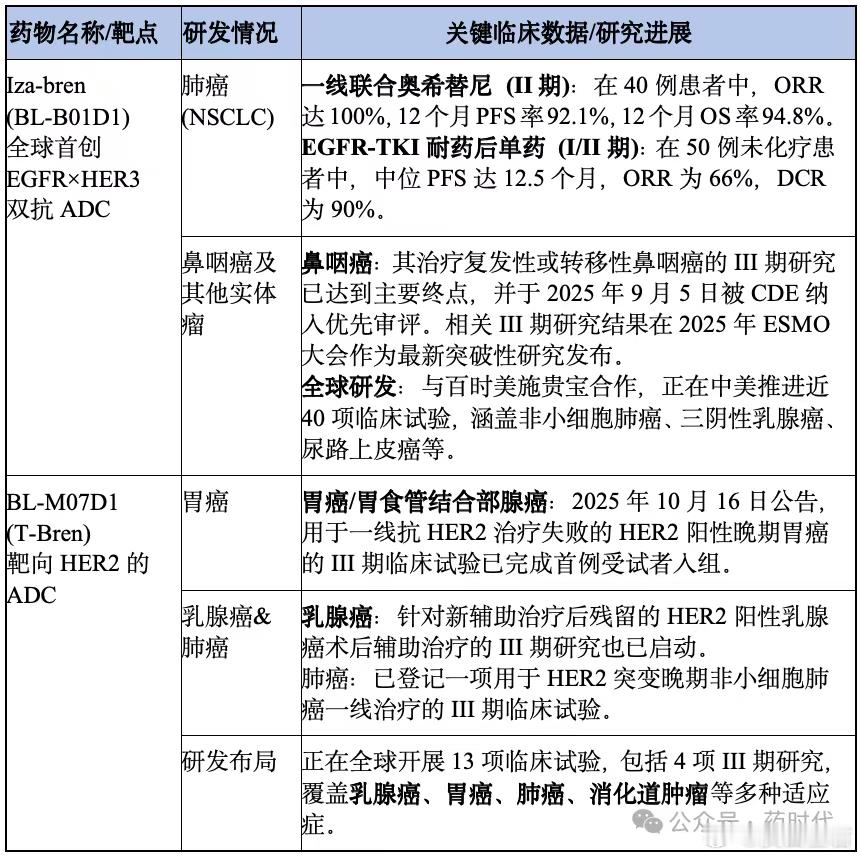
表6 4款ADC药物目前已公开的临床数据其中百利天恒的Iza-bren (BL-B01D1)作为全球首个进入III期临床的EGFRxHER3双抗ADC,其在非小细胞肺癌、乳腺癌、卵巢癌等多个实体瘤中展示了令人鼓舞的疗效和可控的安全性。这获得了FDA的突破性疗法认定,并与BMS达成全球合作,是中国创新“出海”的标杆;BL-M07D1:作为一款具有“同类最佳”潜力的HER2 ADC,其在乳腺癌和胃癌中的数据也入选了本次大会的展示。
表7 两款ADC药物临床研发数据
4.2第一梯队报产在即以科伦博泰/默沙东的SKB264 (TROP2 ADC)、恒瑞的SHR-A1811 (HER2 ADC)等为代表的上市产品,以及百利天恒的BL-B01D1 (EGFRxHER3 ADC)、映恩生物的DB-1303等新秀,已陆续公布多项适应症关键的II/III期研究数据,路径清晰,多项适应症预计在2026-2027年集中提交上市申请。
4.3供应链最先受益ADC药物的复杂结构决定了其生产高度依赖专业的CDMO。议程中火爆的ADC研发背后,是药明生物、迈百瑞、奥浦迈等中国CDMO和linker-payload(如宜联生物的YLX-Payload)供应商的巨大机遇。它们的发展速度甚至快于药企本身。
小结
ESMO 2025的议程,如同一张精细绘制的新大陆航海图,清晰地标示出肿瘤药物研发的富矿区和未来航线。在这张图上,我们看到的不是一个孤立的“奇迹靶点”,而是一个由“技术平台”和“治疗模式”主导的新时代。
千亿分子的诞生逻辑已然改变。它不再仅仅依赖于发现一个全新的基因,而更多地在于:能否以一种革命性的方式,重新定义并攻克一个庞大的临床需求。
它可能诞生于老靶点的新生命:谁能像德曲妥珠单抗那样,通过ADC技术将HER2的疆域从“阳性”拓展到“低表达”,谁就能开启一个百亿市场。如今,TROP2、CLDN18.2等靶点正在这条路上狂奔。
它更必然依赖于平台化的孵化能力:第一三共的DXd、宜联生物的YLX-Payload……这些能够持续产出同类最优或同类首创药物的技术平台,才是这个时代最宝贵的资产,它们本身就是千亿分子的母体。