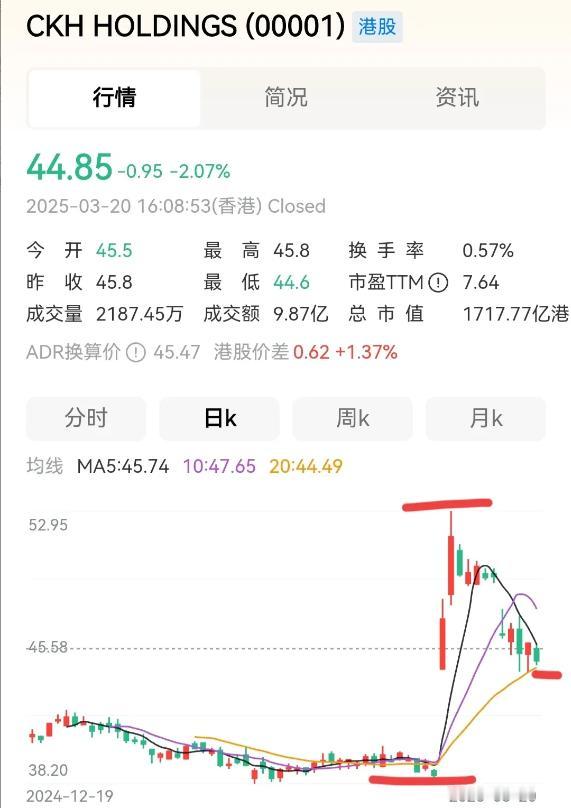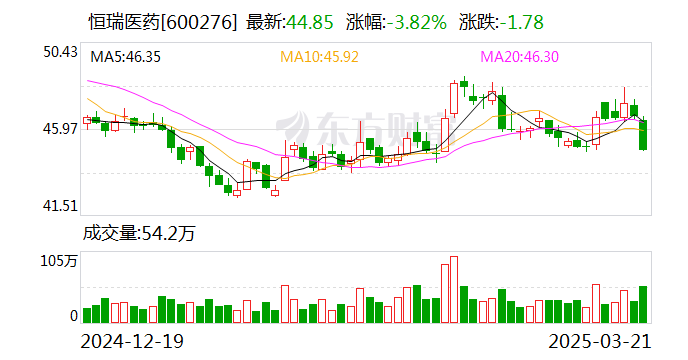
3月21日,恒瑞医药(600276.SH)二级市场上的股价跌幅达到3.82%,而盘面上传闻称,恒瑞医药的韩国合作伙伴HLB对外透露“双艾”疗法(卡瑞利珠单抗联合阿帕替尼)的上市申请未获得美国FDA批准。
3月21日傍晚,第一财经记者从恒瑞医药方面获悉,公司与韩国合作伙伴合作开发的“双艾”方案在美上市再次收到FDA发出的完整回复函。回复信中,FDA表示相关生产场地检查需进一步提交答复,但FDA并未在回复信中说明具体原因。
恒瑞医药表示,相关生产场地在2025年1月再次接受FDA检查,FDA核实去年发出CRL(完整回复函)的检查中发现的问题都已经整改完毕,仅提出了3个新的改进要求,公司在规定时间内已对相关问题进行了积极回复,并一直与FDA保持密切沟通。公司将在确认具体原因后尽快采取措施并重新提交申请,以期能够获得批准。
卡瑞利珠单抗即为恒瑞医药的PD-1。2023年7月,卡瑞利珠单抗(艾瑞卡)联合阿帕替尼(艾坦)用于晚期肝癌一线治疗适应证上市申请首次获得美国FDA受理。“双艾”疗法被市场寄予厚望,因为这关系到恒瑞医药的创新药首次在美国市场上市。
然而,“双艾”疗法在美的上市,却是一波多折,这已经是第二次延迟上市了。第一次延迟上市是在2024年5月,原因是FDA要基于企业对生产场地检查缺陷的完整答复进行全面评估;并且由于部分国家的旅行限制,FDA在审查周期内也无法全部完成该项目必需的生物学研究监测计划(BIMO)临床检查。
2024年10月,恒瑞医药重新提交卡瑞利珠单抗联合阿帕替尼片用于不可切除或转移性肝细胞癌患者的一线治疗的生物制品许可申请获得FDA受理。按照当时的计划,根据《处方药用户付费法案(PDUFA)》,FDA对注射用卡瑞利珠单抗的目标审评日期为2025年3月23日。
在中国市场中,卡瑞利珠单抗获批的适应证已达到九个。2023年1月,卡瑞利珠单抗联合阿帕替尼在中国获批晚期肝细胞癌一线治疗适应证,是中国首个获批用于治疗晚期肝细胞癌的PD-1抑制剂与小分子抗血管生成药物组合。
截至目前,中国获批上市的PD-1(L1)上市的数量已超过10款。市场竞争白热化下,国产PD-1(L1)也在寻求出海,已有两款国产PD-1成功实现在美国上市,分别是君实生物的PD-1特瑞普利单抗以及百济神州的PD-1替雷利珠单抗。而海外价格差异明显,如特瑞普利单抗在美国年治疗费用是中国价格的近34倍;替雷利珠单抗在美国的定价比K药/O药低10%。
值得一提的是,在恒瑞医药之前,也有其他国产PD-1,如信达生物的信迪利单抗,也曾出现赴美上市遇挫的情况。截至目前,信达生物的信迪利单抗还未获批在美国上市。