IT之家1月26日消息,德国斯图加特大学第二物理研究所科研团队开发出了一种可改造人造细胞的DNA纳米机器人,团队中包括多位中国学生和教授。
这一创新技术能控制合成细胞中脂质膜的形状和通透性,为合成生物学发展提供了全新工具。相关研究成果已于1月13日发表在最新一期《自然・材料》杂志上。

细胞的形状和结构对其生物功能至关重要,这反映了现代设计中常见的“形式追随功能”原则。该原则强调结构应根据其预期用途来决定,而能否将此原则应用于人造细胞,正是合成生物学面临的重要挑战之一。
该如何将这一概念应用于人工细胞是合成生物学中属于是一项重大挑战。针对这一问题,该团队开发出了一种创新工具,用于控制合成细胞中脂质膜的形状和渗透性。
这些膜由包含水性隔室的脂质双层组成,是生物膜的简化模型。它们可用于研究膜动力学、蛋白质相互作用和脂质行为。
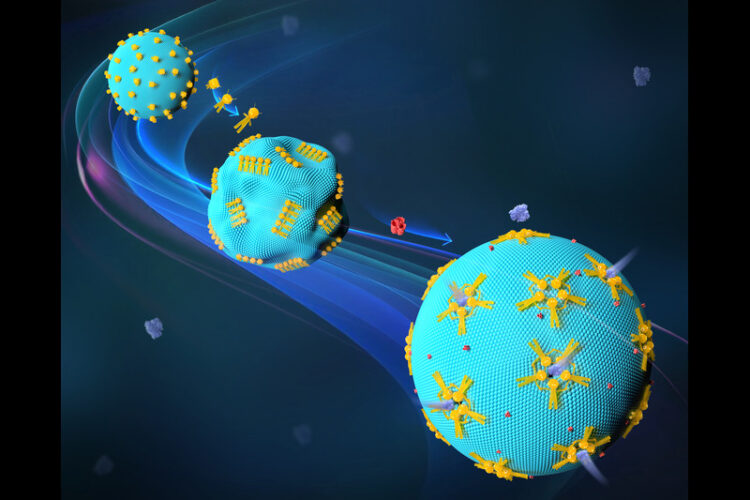
利用信号依赖性的DNA纳米机器人,团队此次实现了与合成细胞的可编程交互,这是应用DNA纳米技术调控细胞行为的重要一步。他们利用一种模仿活细胞的简单结构——巨型单层囊泡(GUV),通过DNA折纸技术构造可重构纳米机器人。
这种机器人能够在微米尺度上改变周围环境,并且成功地影响了GUV的形状和功能。
研究人员发现,这些DNA纳米机器人的转化可以与GUV的变形以及模型GUV膜中合成通道的形成相结合。这些通道允许大分子通过膜,并且可以在需要时重新密封。
“这意味着我们可以使用DNA纳米机器人来设计GUV的形状和配置,以在膜中形成传输通道,”该论文的合著者StephanNussberger教授表示,“令人非常兴奋的是,DNA纳米机器人在GUV上的功能机制在活细胞中没有直接的生物对应物。”
具体来说,这些变形的DNA纳米机器人可以促使GUV变形并形成合成通道,允许大分子如治疗性蛋白质或酶穿越膜,在需要时还可以重新密封。这表明,DNA纳米机器人可用于设计GUV的形态和配置,从而实现膜内运输通道的形成。
当应用于活细胞时,该系统可以促进治疗性蛋白质或酶输送到细胞中的靶点。因此,它为药物和其他治疗干预措施的管理提供了新的可能性。
这项创新系统有望将大型治疗分子有效地输送到细胞中,为更精确的药物输送和先进的治疗干预措施铺平道路。
