上一期我们讲了酵母双杂交的核心原理,这一期就进入 “实战环节”—— 从感受态制备、转化操作,到对照设置、结果解读,再到常见问题的解决方案,甚至附上实际应用案例,手把手带新手吃透酵母双杂交实验,再也不怕做不出结果或解读错数据。
一、先分清两个核心体系:核体系 vs 膜体系实验前先明确研究对象:若研究核蛋白互作,用核体系;若研究膜蛋白互作(如受体 - 配体),用膜体系,两者原理不同但操作逻辑相通:
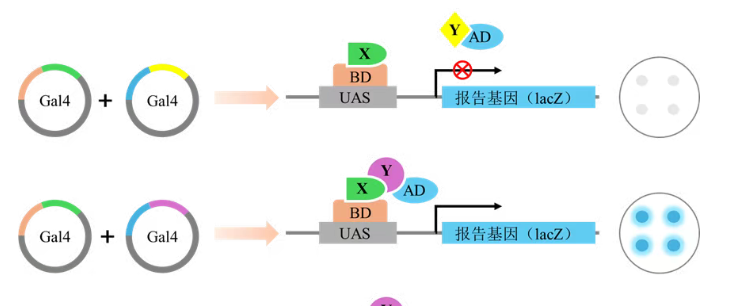
核体系:诱饵蛋白(X-BD)与猎物蛋白(Y-AD)互作→BD 与 AD 靠近→激活下游 His、Ade 等报告基因→酵母在缺对应营养的培养基上生长;
膜体系:诱饵(X-Cub-TF)与猎物(Y-NubG)互作→泛素片段(Cub+NubG)重组→TF 被剪切进入细胞核→激活报告基因,避免膜蛋白进入细胞核的难题。
二、核心实操:感受态制备 + 转化,关键细节别踩坑1. 酵母感受态制备(经费有限版,商用感受态直接跳过此步)感受态质量直接影响转化效率,步骤和细节缺一不可:
从 - 80℃取出酵母菌株(如 Y2HGold、AH109),涂布 YPDA 平板,28℃倒置培养 4-7 天,长出单克隆;
挑取单个克隆接入 10mL YPDA 液体培养基,30℃、250rpm 震荡培养至 OD₆₀₀=1.4-1.8,再扩大培养至 50-100mL,直至 OD₆₀₀=0.6-0.8(重点:OD 值过高会导致感受态活性下降);
1000g 室温离心 5min 收集细胞,弃上清;
加 50mL 无菌超纯水重悬洗涤,1000g 离心 5min,重复 1 次(去除培养基残留);
加 3mL 1.1×TE/LiAc 重悬,等体积分装到新管,6000g 离心 30s,弃上清;
加适量 1.1×TE/LiAc 重悬,100μL / 管分装,-80℃保存(重点:避免反复冻融,影响活性)。
2. 酵母转化(核体系为例)转化步骤虽简单,但细节决定成败:
取出感受态,室温解冻,加入 10μL ssDNA(作用:类似 “保护剂”,避免质粒被酵母核酸酶降解)、0.1μg 质粒(诱饵 + 猎物载体)、600μL PEG/LiAc,涡旋混匀(重点:PEG/LiAc 需现配,浓度不对会影响转化效率);
30℃水浴 30min(让质粒进入细胞),加入 70μL DMSO(增强细胞膜通透性),42℃热激 15min(关键:热激温度和时间不能错,否则细胞死亡);
冰上冷却 2min,2000g 离心 10s,弃上清,加 1mL 无菌水重悬;
取 200μL 涂到对应营养缺陷型平板(如二缺板),28℃倒置培养 2-4 天,观察菌落。
三、对照设置 + 结果解读:这步错了,实验白做!酵母双杂交的核心是 “通过对照排除假阳性 / 假阴性”,必须设置 4 组关键对照,搭配不同培养基判断结果:
1. 必设对照组(核体系为例)对照组质粒组合目的阴性对照pGBKT7-Lam + pGADT7-ADT排除非特异性互作(Lam 与 ADT 无互作)阳性对照pGBKT7-P53 + pGADT7-ADT验证系统有效性(P53 与 ADT 已知互作)自激活组pGBKT7-X + pGADT7检测诱饵蛋白 X 是否单独激活报告基因实验组pGBKT7-X + pGADT7-Y验证 X 与 Y 是否互作2. 培养基与结果判断二缺板(SD/-Trp/-Leu):所有组都长菌落→证明两种质粒均成功转入酵母(转化没问题);若某组不长→转化失败,需重新做;
三缺板(SD/-Trp/-Leu/-His):阳性对照长、阴性对照不长、自激活组不长→系统正常;实验组长→初步判断 X 与 Y 互作;
四缺板(SD/-Trp/-Leu/-His/-Ade):阳性对照长、实验组长→确认 X 与 Y 互作(四缺筛选更严格,减少假阳性);若自激活组长→需用 AbA(金担子素)或 3-AT 抑制自激活;
X-gal 显色:阳性菌落因表达 LacZ 基因,会将 X-gal 切成深蓝色产物→进一步验证互作(非必需,但可增强结果可信度)。
四、常见问题排坑:这些错误新手最常犯!1. 培养基问题:变色、凝固差原因:SD 培养基含葡萄糖,高温灭菌易碳化(颜色变深);琼脂用量不足或 pH 不对导致凝固差;
解决:用 SC 培养基(不含葡萄糖),灭菌后无菌添加葡萄糖;调整琼脂用量(通常 2%),灭菌前调 pH 至 5.8。
2. 酵母生长问题:生长慢、变粉色原因:培养基试剂过期 / 用量不足(营养不够);腺嘌呤浓度低(酵母变粉色);诱饵蛋白有毒性;
解决:检查试剂有效期,按配方准确称量;补充腺嘌呤;若蛋白有毒性,换低拷贝载体表达诱饵。
3. 假阳性问题:筛选到的克隆太多原因:诱饵蛋白自激活;转化浓度过高;筛选不够严格;
解决:用四缺板 + AbA(100-200ng/mL)或 3-AT(10-20mM)增强筛选严格性;降低涂板浓度;截短诱饵蛋白的转录激活结构域。
五、应用案例:酵母双杂交不只是 “验证互作”验证核蛋白互作:研究 UBE2S 与 AKIP1 的互作,阳性对照(P53-ADT)在三缺 / 四缺板长菌落,实验组(AKIP1-UBE2S)也长,结合 Co-IP 实验,确认两者互作;
验证膜蛋白互作:用膜体系验证 KDELR 与 EGFR 的互作,阳性对照(KDELR-ACBD3)长菌落,实验组(KDELR-EGFR)长,阴性对照(KDELR-GLUT4)不长,证明膜蛋白互作;
筛选小分子抑制剂:针对结核分枝杆菌的 FtsZ-SepF 互作,建立酵母双杂交系统,筛选到化合物 T0349,能抑制两者互作,且低毒性,为抗结核药物研发提供靶点。